(14分)
食醋是烹饪美食的调味品,有效成分主要为醋酸(用 表示)。
表示)。 的应用与其电离平衡密切相关。25℃时,
的应用与其电离平衡密切相关。25℃时, 的
的 。
。
(1)配制 的
的 溶液,需
溶液,需 溶液的体积为_______mL。
溶液的体积为_______mL。
(2)下列关于 容量瓶的操作,正确的是_______。
容量瓶的操作,正确的是_______。
(3)某小组研究25℃下 电离平衡的影响因素。
电离平衡的影响因素。
提出假设。稀释 溶液或改变
溶液或改变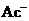 浓度,
浓度, 电离平衡会发生移动。设计方案并完成实验用浓度均为
电离平衡会发生移动。设计方案并完成实验用浓度均为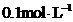 的
的 和
和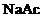 溶液,按下表配制总体积相同的系列溶液;测定
溶液,按下表配制总体积相同的系列溶液;测定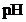 ,记录数据。
,记录数据。
序号 | 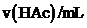
| 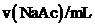
| 
| 
| 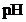
|
Ⅰ | 40.00 | / | / | 0 | 2.86 |
Ⅱ | 4.00 | / | 36.00 | 0 | 3.36 |
… | | | | | |
Ⅶ | 4.00 | a | b | 3:4 | 4.53 |
Ⅷ | 4.00 | 4.00 | 32.00 | 1:1 | 4.65 |
①根据表中信息,补充数据: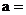 _______,
_______,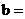 _______。
_______。
②由实验Ⅰ和Ⅱ可知,稀释 溶液,电离平衡_______(填”正”或”逆”)向移动;结合表中数据,给出判断理由:_______。
溶液,电离平衡_______(填”正”或”逆”)向移动;结合表中数据,给出判断理由:_______。
③由实验Ⅱ~VIII可知,增大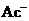 浓度,
浓度, 电离平衡逆向移动。
电离平衡逆向移动。
实验结论假设成立。
(4)小组分析上表数据发现:随着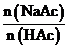 的增加,
的增加,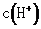 的值逐渐接近
的值逐渐接近 的
的 。
。
查阅资料获悉:一定条件下,按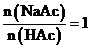 配制的溶液中,
配制的溶液中,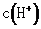 的值等于
的值等于 的
的 。
。
对比数据发现,实验VIII中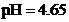 与资料数据
与资料数据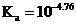 存在一定差异;推测可能由物质浓度准确程度不够引起,故先准确测定
存在一定差异;推测可能由物质浓度准确程度不够引起,故先准确测定 溶液的浓度再验证。
溶液的浓度再验证。
①移取 溶液,加入2滴酚酞溶液,用
溶液,加入2滴酚酞溶液,用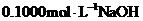 溶液滴定至终点,消耗体积为
溶液滴定至终点,消耗体积为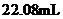 ,则该
,则该 溶液的浓度为_______
溶液的浓度为_______ 。在答题卡虚线框中,画出上述过程的滴定曲线示意图并标注滴定终点_______。
。在答题卡虚线框中,画出上述过程的滴定曲线示意图并标注滴定终点_______。
②用上述 溶液和
溶液和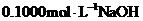 溶液,配制等物质的量的
溶液,配制等物质的量的 与
与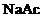 混合溶液,测定pH,结果与资料数据相符。
混合溶液,测定pH,结果与资料数据相符。
(5)小组进一步提出:如果只有浓度均约为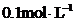 的
的 和
和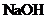 溶液,如何准确测定
溶液,如何准确测定 的
的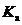 ?小组同学设计方案并进行实验。请完成下表中Ⅱ的内容。
?小组同学设计方案并进行实验。请完成下表中Ⅱ的内容。
Ⅰ | 移取 溶液,用 溶液,用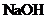 溶液滴定至终点,消耗 溶液滴定至终点,消耗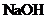 溶液 溶液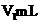 |
Ⅱ | _______,测得溶液的pH为4.76 |
实验总结得到的结果与资料数据相符,方案可行。
(6)根据 可以判断弱酸的酸性强弱。写出一种无机弱酸及其用途_______。
可以判断弱酸的酸性强弱。写出一种无机弱酸及其用途_______。